
一种超高通量的微流控芯片以用于分选CTC。
Introduction
CTCs是导致大多数癌症相关死亡的(癌细胞)转移性疾病的主因。大多数的CTCs具有有限的半衰期,不能在血循环的高物理和氧化压力里存活,但是一小部分细胞保持活性并激发远处器官的转移性病灶。所有完整的CTCs都提供了丰富的细胞标志物,用于监测治疗压力下的癌症进展和演变。在治疗过程中对CTC进行血液采样可以确定是否获得了简单的体细胞突变或复杂的DNA改变以及RNA或蛋白质组成的变化,从而可以对目标药物作用进行药代动力学测量。然而其在标准血样管中极稀有的数量限制了其临床应用。
最有前途的CTC富集技术是微流控装置,其高效率和低应力处理最大限度地增加了可行的CTC回收的机会。相比于基于预定义的性质主动分选CTCs,作者开发了一种基于磁性分选造血细胞的策略,这样剩下来的就是CTCs,且不受表位影响。
本文针对的是分离白细胞分离术术产物的CTCs,产物中的白细胞、血小板等浓度远远高出通常使用的10 mL全血,对当前已有设备形成了挑战。
Fig. 1.
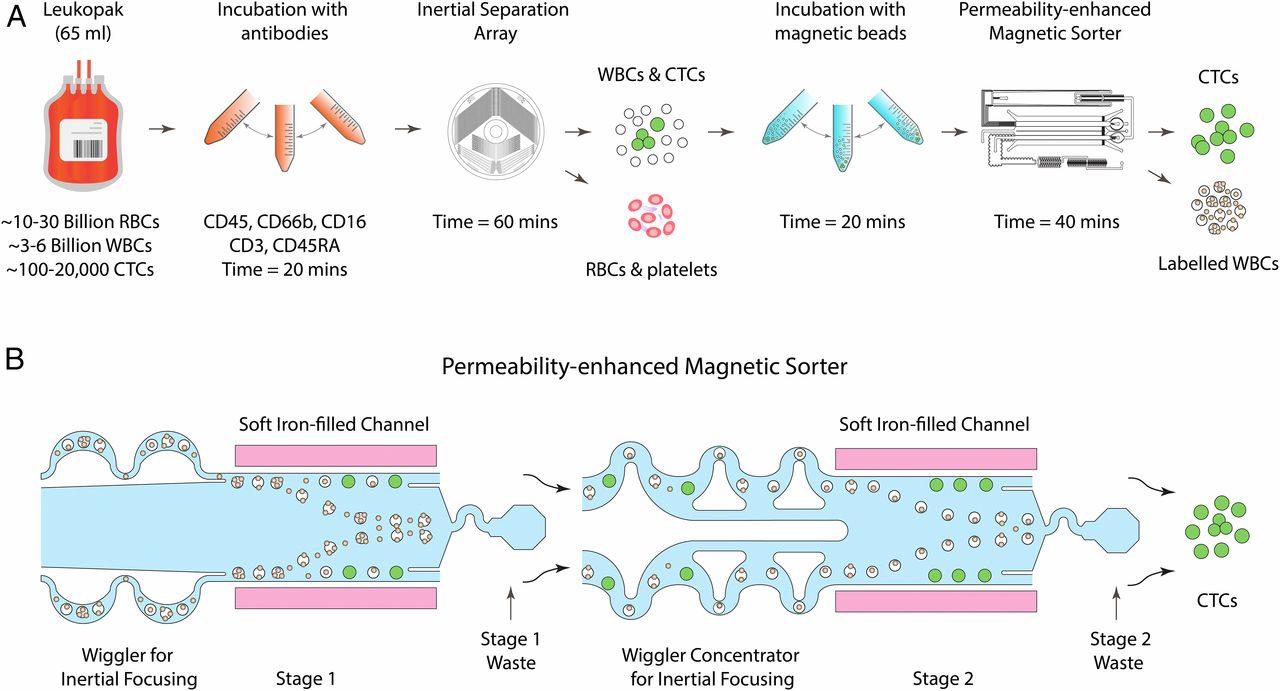
- (A)用于从白细胞分离术术产物中进行非接触的CTC分离的微流控方法示意图。大约5L血量中的白细胞分离术术产物通常包含三到六十亿的有核细胞。首先使用基于尺寸的惯性分离将红细胞和血小板从白细胞分离术术产物中分离。接着使用免疫磁性移除白细胞,使能够在不依赖抗原标记的情况下恢复未接触的CTCs。
- (B)该示意图显示了磁导率增强型磁分选机,该选别机每小时可从浓缩的白细胞分离术产品中消耗约30亿白细胞。该芯片使用两个相邻的通道,在分选通道的每一侧各有一个通道,这些通道紧密地堆积着软磁铁颗粒。这些高磁导率通道将磁场梯度提高了35倍,使能够以超高通量地同时偏转每个磁性标记的细胞。
Fig. 2.

- (A)一个全面的图解描述磁性分选器的微流控设计。在第一阶段,细胞流过微过滤器,随后聚焦成单行流。通过缓冲液流使其紧紧靠近分选通道的侧壁,而白细胞则被转移到废液口。其余的样品通过一对惯性聚焦微流体浓缩器流入第二阶段,在该阶段浓缩产物被收集同时,所有的自由磁珠和每个被标记的细胞都被磁偏转至废液口。插图1到7显示了磁分选机从入口到出口中各个位置的白细胞的荧光条纹图像。插图8显示了产品端处分离的CTCs的荧光条纹图像。
- (1)磁标记的细胞悬浮液通过两套微流控入口过滤器(40 μm孔径)进入第一阶段,以除去较大的碎片或聚集物。基于过滤器2曲折的通道几何形状的长度,直径小于过滤器1的孔径的微小碎片被捕获。
- (2)过滤后,细胞悬液通过2个不对称的蛇形通道以48 mL/h的流速流入第一阶段分选通道,这2个通道会通过惯性将细胞聚焦为单行流。这些蛇形通道利用剪切诱导升力和基于Dean流的阻力之间的平衡,将细胞聚焦在蛇形通道中心附近。
- (3)在分选通道核心,提供了120 mL/h的速度的缓冲液流,以保证惯性聚焦的细胞接近通道壁,那里的磁场梯度最大。
- (4)当白细胞通过偏转通道时,它们会受到磁力的作用,并向通道中心偏转(因为中间是高梯度区域),进入第一阶段的废液口。
- (5)第一阶段后,细胞流通过另一个微流控过滤器和两个基于惯性聚焦的细胞浓缩器进入第二阶段。
- (6)细胞浓缩器通过连续地创造无细胞区和使用被动流体控制阻力反复虹吸。重复超过140的单元,直到最后获得20倍的细胞浓度。
- (7)6个支流通道将浓缩的细胞悬浮液供应到第二阶段的分选通道,在此通道中,细胞聚焦的任何损失都被6个惯性聚焦单元纠正,细胞被放置在靠近通道侧壁的单行流中。
- (8)第二阶段的分选通道中,每个被磁珠标记的细胞被偏转到废液口,未偏转的CTCs以11倍浓缩的体积被收集。
- (B)微制造(PDMS)的磁分选装置的图像。
Fig. 3.
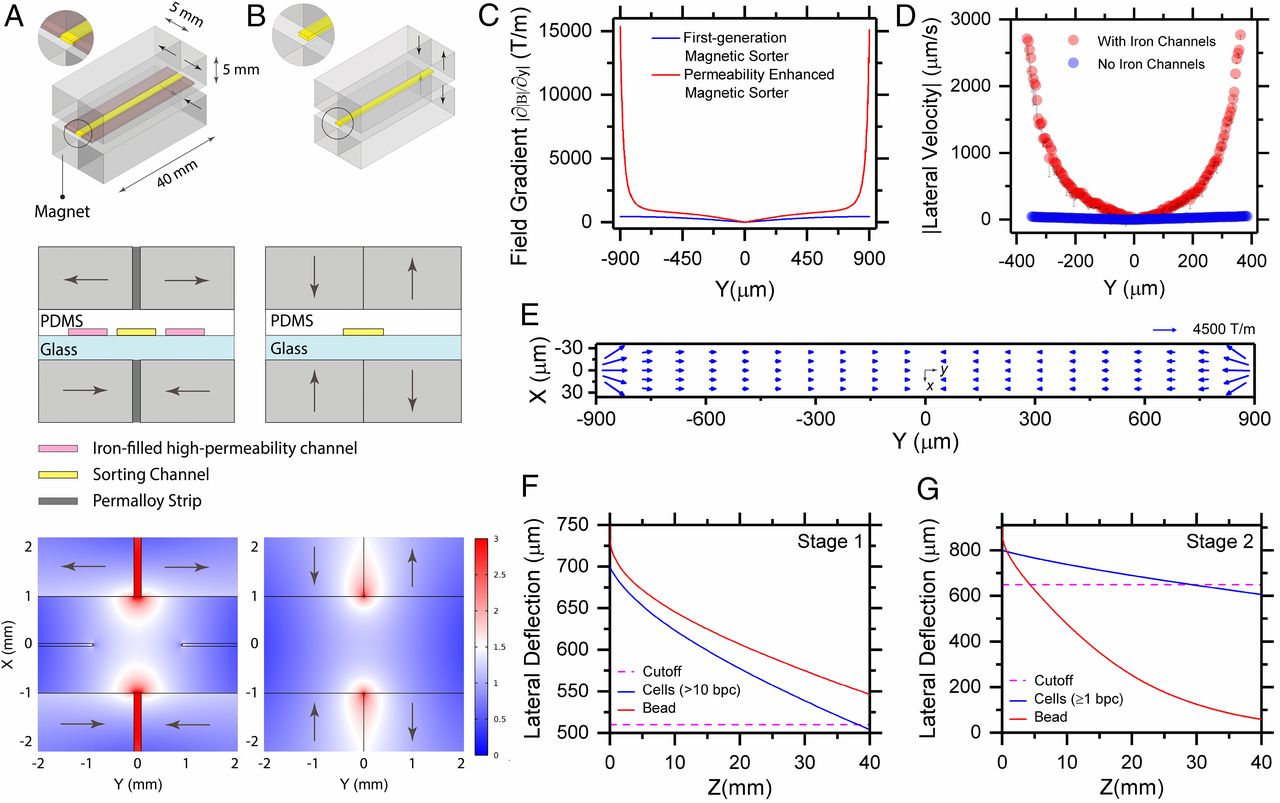
假定超顺磁性的粒子充分标记细胞,横向的磁力与粘附在细胞上的粒子成比例,为了获得单磁珠标记的细胞的偏转,增加的磁场梯度对改善磁力乃至于通量十分重要。
- (A)
- (上和中)磁分选机中永磁体和高磁导率通道的布置,以四极排列方式使用N52级钕铁硼(NdFeB)矩形磁体。
- (下)磁场强度的等值线图。在磁铁之间的高磁导率通道和坡莫合金带放大了分选区域的磁场。
- (B)CTC-ichip[2]中使用的第一代磁分选机中磁体的排列及相应磁场的等值线图。该分选机未使用高渗透通道。
- (C)磁导率增强的磁分选机和第一代磁分选机[2]磁场梯度比较。软磁铁填充通道起到芯片上微磁透镜的作用,使磁场梯度增加35倍。
- (D)场增强的实验验证。使用粒子追踪测速仪,我们测量发现含铁通道中的2.8 μm磁珠的横向偏转速度明显更高。为了直接观察分选通道,使用了磁体之间间隙为4 mm的配置(见下图)。
- (E)分选通道中磁场强度梯度的向量图,向量位于其各自的中点。在侧壁区域中也存在明显的梯度x分量(图3E),但在距侧壁100 μm内衰减至〜250 T/m,并且可以忽略不计(<50 T/m)
- (F)第一阶段1 μm磁珠和细胞的偏转。大于10个磁珠的细胞和绝大部分自由磁珠被偏转到废液口。
- (G)第二阶段磁珠和细胞的横向偏转。所有自由磁珠和每个被标记的细胞被偏转到废液口。
Fig. 4.
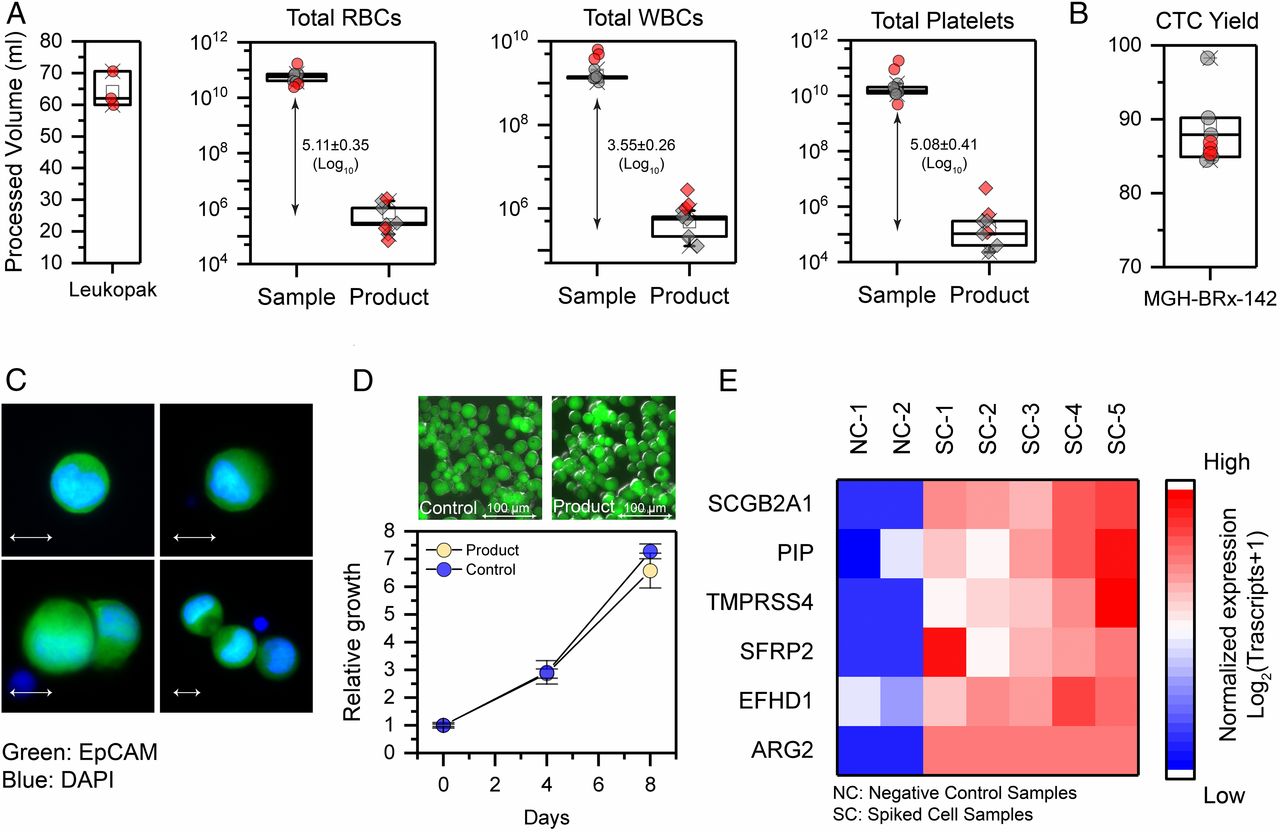
- (A)白细胞分离术样本容量以及完全的白细胞分离术样品(红色符号)、模拟样本(灰色符号)和分离产物中的去除数据、细胞数量比较。平均而言,作者处理了64.2 ± 4.6 mL白血病分离术。获得了log10 5.11、3.55、5.08 的红细胞、白细胞、血小板去除率。
- (B)CTC分离产量。在白细胞分离术样本中,作者恢复了86.1%分散的MGH-BRx-142细胞,模拟样本中有更高的产量89.2%。
- (C)分离的MGH-BRx-142的免疫荧光图像,其中上皮细胞黏附分子(EpCAM,绿色),DAPI(蓝色)。表明了分离的CTCs形态没有变化。
- (D)通过测量细胞中ATP的含量,分离的CTCs在产品和对照中的相对体外生长情况。插图显示MGH-BRx-142培养细胞的图像。表明了微流控过程不会损害CTCs的增殖特性。
- (E)使用ddPCR分析测量CTC富集后分散的MGH-BRx-142细胞乳腺谱系标记物的表达。阴性控制组是健康捐献样本,没有CTC分散。表明分离的CTCs有完整的RNA,适合分子分析。
Discussion
现存的CTC分离技术固有地受到标准10 mL管全血中微小CTC的数量的限制。尽管关于CTC的研究提供了对血源性转移过程的重要见解,但将基于CTC的诊断方法纳入临床治疗仍需要从血液中持续分离出足够数量的癌细胞。从约5 L的血液生成的白细胞分离术产物是理想的初始材料。早期用EpCAM阳性标记CTC的方法限制了癌细胞类型(即高表达上皮标记的亚型)。另外,在肿瘤细胞表面的结合了磁珠的捕获抗体,限制了它们的功能活力、RNA的质量以及详细成像和形态分析的可行性。
本芯片的关键创新在于强大的磁分选机,其磁透镜获得了比传统磁分选机更高(30倍)的细胞偏离。传统的磁场设计中,高负载磁珠的细胞会迅速粘附通道壁以形成斑块堵塞通道,导致装置失败。实际上,先前的高梯度磁分选机将铁磁轨道定位到通道下方,从而使标记的细胞偏向通道顶壁或底壁,从而在高通量操作时很可能会造成白细胞堵塞。作者的磁分选机设计中,通过将细胞偏转到没有壁存在的、通道的中心,并远离高磁梯度区域来防止这种情况,因此具有高磁负载的细胞可以迅速聚焦在通道的中心。
作者当前移除红细胞、血小板和白细胞的方法是使用2个分离的流体未连接装置,在2个芯片间转移时可能会造成CTC丢失。另一个缺陷是由于CTC簇、CTC-WBC簇的存在,可能会丢失非常稀少的CTC。
Reference
[1] Mishra A, Dubash T D, Edd J F, et al. Ultrahigh-throughput magnetic sorting of large blood volumes for epitope-agnostic isolation of circulating tumor cells[J]. Proceedings of the National Academy of Sciences, 117(29): 16839–16847.
[2] Fachin F, Spuhler P, Martel-Foley J M, et al. Monolithic Chip for High-throughput Blood Cell Depletion to Sort Rare Circulating Tumor Cells[J]. Sci Rep, 2017, 7(1): 10936.




